Dr. Rafael Amaral de Castro, CRM-DF 13827
CLÍNICA MÉDICA - RQE Nº: 9934
ONCOLOGIA CLÍNICA - RQE Nº: 10032
Câncer de Pulmão: O Guia Completo e Atualizado para 2025
Em busca de informações detalhadas e confiáveis sobre o tratamento do Câncer de Pulmão? No blog da Neoaccess, o Dr. Rafael Amaral de Castro oferece artigos completos baseados nos protocolos mais recentes de 2025. Aprofunde-se em temas como biologia molecular, estadiamento (TNM), terapias-alvo, imunoterapias e muito mais. Além disso, assista ao nosso vídeo de 5 minutos para um resumo prático. Sua fonte de conhecimento em oncologia está aqui! Leia o Artigo / Visitar Site www.neoaccess.med.br WhatsApp Business: 61981979192 youtube da neoaccess: https://www.youtube.com/channel/UCySIKd0ygqU8PT7iTNG-YKw instagram rafaelcastroonco: https://www.instagram.com/rafaelcastroonco/@NEOACCESS.MED Hashtags Sugeridas: #Neoaccess #BlogDeSaúde #CâncerDePulmao #OncologiaAtualizada #DrRafaelAmaral #InformaçãoConfiável #TratamentoCâncer #MedicinaDePrecisão #EducaçãoEmSaúde
Dr. Rafael Amaral de Castro
9/29/202517 min read
assista o vídeo resumo em português aqui
assista vídeo avançado sobre bloqueio EGFR aqui
assista vídeo avançado sobre outras mutações aqui
assista vídeo avançado sobre imunoterapia aqui
Desvendando o Câncer de Pulmão: Um Guia Completo para Pacientes
Dr. Rafael Amaral de Castro - Neoaccess.med.br
Receber o diagnóstico de câncer de pulmão pode ser um momento avassalador, repleto de incertezas e medos. No entanto, é fundamental saber que a medicina está em constante evolução, e hoje contamos com avanços extraordinários que transformaram o prognóstico e a qualidade de vida de muitos pacientes. Meu objetivo com a Neoaccess e com este guia é justamente trazer luz e clareza sobre os "Protocolos Atualizados de Tratamento do Câncer de Pulmão", que são os caminhos que a ciência nos indica para combater esta doença.
Se você está aqui, seja como paciente, familiar ou cuidador, saiba que não está sozinho(a). A informação é o primeiro passo para tomar decisões conscientes e enfrentar a doença com mais segurança. Juntos, vamos entender o que é o câncer de pulmão, como ele é diagnosticado, estadiado e, principalmente, quais são as estratégias de tratamento mais modernas e personalizadas disponíveis hoje.
O Câncer de Pulmão no Brasil e no Mundo: Uma Luta Compartilhada
O câncer de pulmão é, infelizmente, uma das principais causas de mortalidade por câncer em todo o mundo. Em 2022, mais de 2,4 milhões de novos casos foram registrados, e a doença superou a soma de óbitos de outros cânceres como o de mama, próstata e colorretal. No Brasil, as estimativas do Instituto Nacional de Câncer (INCA) para 2023-2025 o colocam entre os cânceres mais comuns, tanto em homens quanto em mulheres.
É importante ressaltar que o tabagismo é o fator de risco mais significativo, responsável por uma grande parte dos casos. Parar de fumar é a medida mais eficaz para reduzir o risco. No entanto, é crucial entender que o câncer de pulmão pode afetar qualquer pessoa, mesmo quem nunca fumou.
Dois Mundos Diferentes: Câncer de Pulmão de Não Pequenas Células (CPNPC) e Câncer de Pulmão de Pequenas Células (CPPC)
Embora ambos sejam cânceres de pulmão, o CPNPC e o CPPC são como "primos" distantes. Eles se comportam de maneiras diferentes, têm características moleculares distintas e, por isso, exigem abordagens de tratamento específicas.
O CPNPC é o tipo mais comum, representando cerca de 85% dos casos. É uma doença muito heterogênea, ou seja, pode se apresentar de diversas formas. Já o CPPC é menos frequente (10-15% dos casos), mas é conhecido por ser mais agressivo e se espalhar rapidamente.
Vamos mergulhar em cada um deles:
Câncer de Pulmão de Não Pequenas Células (CPNPC): A Era da Medicina de Precisão
O CPNPC é um câncer complexo, mas também é onde a medicina de precisão tem feito a maior diferença. Isso significa que o tratamento é cada vez mais "sob medida" para as características específicas de cada tumor.
Subtipos Histológicos: Por Que Eles Importam?
Dentro do CPNPC, existem três principais subtipos, identificados pela análise das células ao microscópio (histologia):
1. Adenocarcinoma: É o mais comum, representando cerca de 40% dos casos. Tende a ser encontrado em pessoas que nunca fumaram e geralmente se localiza na periferia do pulmão. É neste subtipo que encontramos a maior probabilidade de "mutações acionáveis", que são alterações genéticas específicas que podem ser combatidas com medicamentos-alvo.
2. Carcinoma Escamoso (Epidermoide): Corresponde a 25-30% dos CPNPC e está fortemente ligado ao tabagismo. Geralmente surge nas vias aéreas maiores, mais centrais no pulmão. Embora menos propenso a mutações acionáveis, a imunoterapia tem um papel crucial em seu tratamento.
3. Carcinoma de Grandes Células: É um diagnóstico menos comum (cerca de 10%) e se caracteriza por células grandes e pouco diferenciadas. A busca por alvos moleculares pode ser mais desafiadora aqui.
A identificação correta do subtipo histológico é o primeiro passo para direcionar os exames moleculares e o plano de tratamento.
Vias Moleculares e Mutações Acionáveis: A Chave para Terapias Personalizadas
Imagine que o câncer cresce porque algumas "chaves" (mutações) ligam constantemente "interruptores" (vias moleculares) que estimulam o tumor. A medicina de precisão busca identificar essas chaves para usar "fechaduras" (terapias-alvo) que as bloqueiem. A pesquisa dessas alterações genéticas é fundamental e pode ser a diferença entre um tratamento que funciona para a maioria e um tratamento que funciona especificamente para você.
As mutações mais importantes que buscamos no CPNPC incluem:
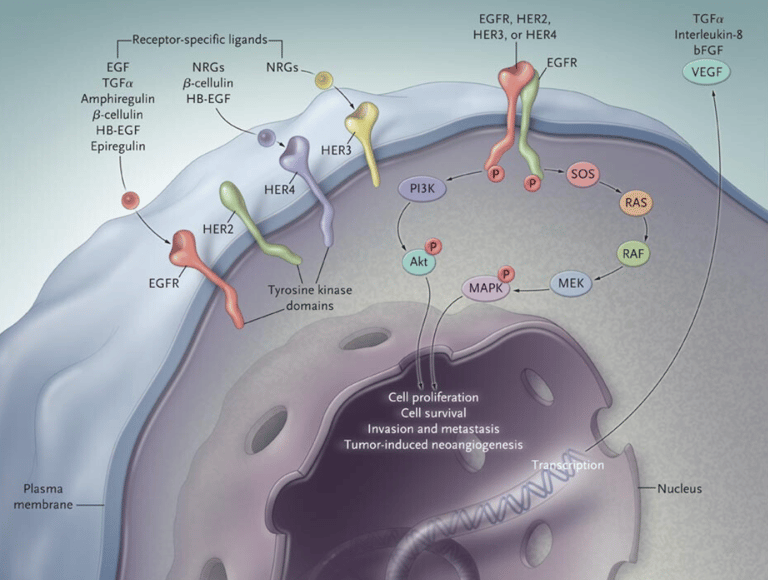
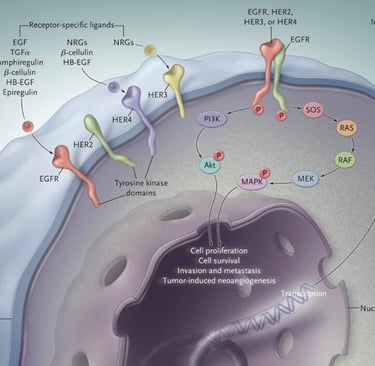
● EGFR (Receptor do Fator de Crescimento Epidérmico): As mutações ativadoras neste gene são as mais frequentes, especialmente em adenocarcinomas e em pacientes de ascendência asiática. Existem inibidores de tirosina quinase (TKIs) específicos para bloqueá-las, como o osimertinibe. Novas combinações e medicamentos estão surgindo, como lazertinibe + amivantamabe.
● ALK (Quinase do Linfoma Anaplásico): Rearranjos neste gene são encontrados em uma pequena porcentagem de pacientes, geralmente não fumantes com adenocarcinoma. Inibidores de ALK (como alectinibe, brigatinibe, lorlatinibe) são muito eficazes.
● ROS1 (Oncogene do Sarcoma de Rato 1): Rearranjos, embora raros, também são sensíveis a TKIs específicos (crizotinibe, entrectinibe, taletrectinibe, repotrectinibe), que oferecem respostas duradouras.
● BRAF (Proto-oncogene B-Raf): Mutações neste gene podem ser tratadas com a combinação de inibidores de BRAF e MEK (dabrafenibe + trametinibe).
● RET (Rearranjado durante a Transfecção): Rearranjos no gene RET respondem a inibidores seletivos (selpercatinibe, pralsetinibe).
● NTRK (Receptor de Tirosina Quinase Neurotrófico): Fusões raras, mas altamente sensíveis a inibidores de NTRK (larotrectinibe, entrectinibe).
● HER2 (Receptor 2 do Fator de Crescimento Epidérmico Humano): Mutações no HER2 podem ser tratadas com conjugados anticorpo-droga (ADCs) como o trastuzumabe deruxtecana.
● MET (Fator de Transição Epitelial-Mesênquimal): Alterações no gene MET, como amplificações ou mutações de "skipping" no éxon 14, são sensíveis a inibidores de MET (capmatinibe, tepotinibe).
● KRAS G12C: Uma mutação muito comum, agora com inibidores específicos (sotorasibe, adagrasibe).
A Importância do PD-L1: Além das mutações genéticas, avaliamos a expressão de PD-L1 (ligante de morte programada 1). O PD-L1 é um biomarcador que indica a probabilidade de o tumor responder à imunoterapia. Quanto maior a expressão de PD-L1 no tumor, maior a chance de a imunoterapia funcionar sozinha ou em combinação.
Como Investigamos o Câncer de Pulmão: O Caminho para o Diagnóstico e Estadiamento
O caminho para definir o tratamento ideal começa com uma investigação minuciosa.
1. Investigação Molecular Abrangente: Para CPNPC, especialmente o adenocarcinoma, a investigação molecular é crucial. A técnica preferencial hoje é o Sequenciamento de Nova Geração (NGS). Imagine o NGS como um "leitor" que consegue analisar simultaneamente muitos genes do tumor em busca de todas as mutações e alterações genéticas conhecidas. Isso nos dá um mapa completo do seu câncer, otimizando o uso do tecido (que muitas vezes é limitado) e permitindo encontrar mutações raras.
Em casos de urgência ou quando o tecido é insuficiente, podemos usar testes mais rápidos para as mutações mais comuns, ou até mesmo uma biópsia líquida (análise de DNA tumoral circulante no sangue) para algumas mutações, embora a biópsia de tecido ainda seja o padrão-ouro. A avaliação do PD-L1 por imuno-histoquímica (IHC) é obrigatória e feita junto com a análise molecular.
2. Exames de Imagem para Estadiamento: O estadiamento, ou seja, determinar a extensão do câncer no corpo, é vital para definir o melhor tratamento. Para isso, utilizamos:
● Tomografia Computadorizada (TC) de Tórax e Abdome Superior: Ajuda a ver o tumor principal, linfonodos e possíveis metástases em órgãos como fígado e adrenais.
● PET-CT (Tomografia por Emissão de Pósitrons): Um exame de alta sensibilidade que detecta áreas com metabolismo aumentado (típico de células cancerosas) em todo o corpo. Ele é essencial para encontrar metástases distantes que a TC pode não ver, evitando tratamentos desnecessários e garantindo que o câncer não esteja subestimado.
● Ressonância Magnética (RM) de Crânio: É obrigatória para todos os pacientes com CPNPC, mesmo sem sintomas. O câncer de pulmão tem uma alta incidência de metástases cerebrais, e a RM é o exame mais sensível para detectá-las, mesmo que sejam muito pequenas, o que é crucial para o planejamento do tratamento. Um PET-CT negativo não substitui a RM de crânio.
3. Avaliação do Mediastino (Linfonodos):O mediastino é a região entre os pulmões, onde se localizam linfonodos importantes. A presença de câncer nesses linfonodos (N2 ou N3) tem um grande impacto no prognóstico e no tratamento. Se houver suspeita na TC ou PET-CT, ou em tumores maiores, precisamos confirmar com uma biópsia:
● Ultrassonografia Endobrônquica (EBUS) com Biópsia: Um procedimento minimamente invasivo para coletar amostras de linfonodos do mediastino e do hilo pulmonar.
● Ultrassonografia Endoscópica (EUS) com Biópsia: Complementa o EBUS, acessando linfonodos em áreas mais posteriores e abaixo do diafragma.
● Mediastinoscopia: Considerada o "padrão-ouro" para alguns casos, especialmente se os exames menos invasivos forem negativos, mas a suspeita ainda for alta.
4. Critérios de Estadiamento TNM (AJCC, 9ª Edição): O sistema TNM é uma linguagem universal para descrever a extensão do câncer, combinando três informações:
● T (Tumor): Descreve o tamanho do tumor principal e se ele invadiu estruturas próximas.
● N (Linfonodos): Indica se o câncer se espalhou para os linfonodos próximos.
● M (Metástase): Sinaliza a presença ou ausência de metástases (espalhamento do câncer para órgãos distantes).A combinação desses três elementos define o estágio anatômico da doença (por exemplo, Estágio I, II, III ou IV), que é fundamental para guiar as decisões de tratamento. A 9ª edição do AJCC (adotada em 2025) trouxe refinamentos para uma estratificação ainda mais precisa.
Estratégias de Tratamento para CPNPC: Um Plano Personalizado
A escolha do tratamento é uma decisão complexa, sempre discutida em equipe multidisciplinar, considerando o estágio, a histologia, o perfil molecular, o estado geral de saúde e as preferências do paciente.
1. Cirurgia e Radioterapia (Com Intenção Curativa)
● Cirurgia: É a principal modalidade para pacientes em estágios iniciais (IA, IB, IIA, IIB e alguns casos selecionados de IIIA). O objetivo é a remoção completa do tumor e dos linfonodos, aumentando as chances de cura. A Lobectomia (remoção de um lobo pulmonar) é o padrão. Em tumores menores ou pacientes mais frágeos, podemos considerar ressecções sublobares (Segmentectomia). A remoção dos linfonodos (Linfadenectomia Mediastinal) é essencial para um estadiamento preciso.
● Radioterapia (RT): Tem um papel fundamental em diversas situações:
● SBRT (Radioterapia Corporal Estereotáxica): Para pacientes em estágios iniciais que não podem ou não querem fazer cirurgia. Ela entrega altas doses de radiação de forma muito precisa em poucas sessões.
● Quimiorradioterapia Concomitante: Para doenças localmente avançadas (Estágios IIIA, IIIB) que não são operáveis. É a combinação de quimioterapia e radioterapia administradas ao mesmo tempo para potencializar o efeito.
2. Terapia Neoadjuvante (Antes da Cirurgia)
Essa abordagem, administrada antes da cirurgia, tem três objetivos principais:
● Reduzir o tamanho do tumor, facilitando a cirurgia.
● Erradicar células cancerosas que possam ter se espalhado (micrometástases), mas que ainda não são detectáveis.
● Aumentar as chances de uma resposta patológica completa (nenhuma célula de câncer viável encontrada no tumor após a remoção) e, consequentemente, melhorar a sobrevida a longo prazo.
● Quimioterapia Neoadjuvante Isolada: Antigamente, a quimioterapia antes da cirurgia já mostrava benefícios. Hoje, ela ainda pode ser uma opção para pacientes que não podem receber imunoterapia.
● Quimioimunoterapia Neoadjuvante: A combinação de quimioterapia com imunoterapia (inibidores de PD-1/PD-L1 como o nivolumabe) antes da cirurgia tornou-se a abordagem preferencial para CPNPC ressecável (estágios IB a IIIA) sem mutações acionáveis (EGFR/ALK). Estudos como o CheckMate 816 demonstraram que essa combinação prolonga significativamente o tempo sem a doença (sobrevida livre de eventos) e aumenta as chances de uma resposta patológica completa. Isso é um grande avanço! Outros estudos (NADIM-II, AEGEAN, KEYNOTE-671, CheckMate 77T) reforçam esses benefícios.
3. Terapia Adjuvante (Após a Cirurgia)
Após a remoção cirúrgica do tumor, o tratamento adjuvante visa eliminar qualquer célula cancerosa que possa ter restado e que não era visível, prevenindo a recidiva da doença e melhorando a sobrevida.
● Quimioterapia Adjuvante: É o tratamento padrão para CPNPC em estágios IB (tumores maiores) a IIIA após cirurgia completa, geralmente por 4 ciclos.
● Imunoterapia Adjuvante: Tornou-se uma opção importante, especialmente para pacientes com expressão de PD-L1. Medicamentos como o pembrolizumabe (estudo KEYNOTE-091) e o atezolizumabe (estudo IMpower010) demonstraram melhoria significativa na sobrevida livre de doença em pacientes selecionados.
● Terapia-Alvo Adjuvante:
● Osimertinibe: Para pacientes com CPNPC em estágios IB a IIIB que possuem mutações no EGFR (deleções no éxon 19 ou L858R no éxon 21) após cirurgia e quimioterapia. O osimertinibe, tomado por 3 anos (ADAURA), melhora significativamente o tempo sem a doença e a sobrevida global.
● Alectinibe: Para CPNPC ALK-positivo em estágios IB a IIIA após cirurgia e quimioterapia, o alectinibe demonstrou benefício importante.
Radioterapia Adjuvante (PORT): Não é indicada rotineiramente, mas pode ser considerada em casos específicos, como quando as margens cirúrgicas estão comprometidas (R1/R2) ou em pacientes com envolvimento linfonodal N2 patológico, sempre com uma avaliação cuidadosa dos riscos e benefícios.
4. Tratamento Paliativo (Doença Avançada ou Metastática)
Quando o câncer está avançado ou se espalhou para outras partes do corpo (metastático), o tratamento paliativo foca em controlar a doença, aliviar os sintomas, melhorar a qualidade de vida e prolongar a sobrevida. É crucial que o cuidado paliativo seja introduzido precocemente para oferecer o melhor suporte ao paciente.
Primeira Linha de Tratamento (CPNPC com Mutações Acionáveis): Se o tumor tiver uma das "mutações acionáveis" que mencionamos, a terapia-alvo com inibidores específicos é a abordagem preferencial. Eles geralmente têm altas taxas de resposta, prolongam o tempo sem progressão da doença e têm um perfil de toxicidade mais favorável que a quimioterapia tradicional.
● EGFR: O osimertinibe é o TKI de terceira geração preferencial. Dados do estudo FLAURA2 mostraram que a combinação de osimertinibe com quimioterapia pode ser ainda mais eficaz, especialmente para pacientes com mutação L858R e metástases cerebrais, controlando a doença de forma superior.
● Inserções no éxon 20 do EGFR: A combinação de amivantamabe + quimioterapia é o novo padrão de primeira linha.
● ALK: Inibidores de ALK de nova geração (alectinibe, brigatinibe, lorlatinibe, ensartinibe) são preferenciais, com o lorlatinibe se destacando por sua eficácia também contra metástases cerebrais.
● ROS1: Crizotinibe, entrectinibe, taletrectinibe e repotrectinibe são opções preferenciais, com boa penetração no sistema nervoso central.
● BRAF V600E: Dabrafenibe + trametinibe é a terapia padrão.
● RET: Inibidores seletivos de RET (selpercatinibe, pralsetinibe) são a primeira escolha.
● NTRK: Inibidores de NTRK (larotrectinibe, entrectinibe) são altamente eficazes.
● MET: Inibidores de MET (capmatinibe, tepotinibe) para mutações específicas.
● KRAS G12C: Embora sotorasibe e adagrasibe sejam inibidores importantes, na primeira linha, a imunoterapia com ou sem quimioterapia é preferida.
Primeira Linha de Tratamento (CPNPC sem Mutações Acionáveis e com Expressão de PD-L1): Se o tumor não tiver mutações acionáveis, a imunoterapia, isolada ou combinada com quimioterapia, é a espinha dorsal do tratamento. A escolha depende do nível de expressão de PD-L1:
● PD-L1 ≥ 50%: Pacientes com alta expressão de PD-L1 respondem bem à imunoterapia em monoterapia (pembrolizumabe, atezolizumabe, cemiplimabe). A combinação com quimioterapia pode ser considerada para maior taxa de resposta ou em casos de grande volume de doença.
● PD-L1 1-49%: A quimioimunoterapia (quimioterapia baseada em platina + inibidor de PD-1/PD-L1 como pembrolizumabe, atezolizumabe, durvalumabe, nivolumabe/ipilimumabe) é a abordagem preferencial.
● PD-L1 < 1%: A quimioimunoterapia é o padrão. A imunoterapia sozinha tem eficácia limitada. A combinação de quimioterapia com dupla imunoterapia (nivolumabe + ipilimumabe) tem se mostrado promissora, especialmente para pacientes com PD-L1 negativo (CheckMate 9LA).
CPNPC sem Mutações Acionáveis e sem Expressão de PD-L1 (ou não testado):Nestes casos, a quimioterapia baseada em platina (cisplatina ou carboplatina) é o tratamento principal. As principais quimioterapias associadas são:
- Premetrexed para os CPNPC não escamosos. Tem usar vitamina B12 Intra muscular e comprimidos de acido folínico durante seu uso.
- Taxanos tais como Docetaxel e placlitaxel que atuam na desorganização dos microtúbulos na hora da divisão dos cromossomos entre as células filhas, ao final da mitose. Hoje também tem o Nab-placlitaxel que conjugado torna-se menos tóxico.
- Gencitabina que atua no metabolismo do DNA causando vários erros e levando a apoptose (morte celular).
Linhas Subsequentes de Tratamento: Se o câncer progredir após o tratamento inicial, realizamos novas avaliações (rebiópsia líquida ou tecidual) para identificar novos "drivers" ou mecanismos de resistência. O tratamento então é adaptado, podendo incluir outros TKIs, quimioterapia, imunoterapia ou novos ADCs.
CPNPC: Carcinoma Escamoso - Um Foco Diferenciado
O carcinoma escamoso, embora seja um subtipo de CPNPC, tem algumas particularidades. Ele é menos propenso a ter mutações acionáveis, então o foco principal do tratamento recai na imunoterapia e na quimioterapia.
● Neoadjuvância: A quimioimunoterapia antes da cirurgia (combinações de platina com gencitabina, docetaxel ou paclitaxel, associadas a nivolumabe, pembrolizumabe ou durvalumabe) é a abordagem padrão e tem demonstrado bons resultados.
● Adjuvância: Após a cirurgia, a quimioterapia ainda é importante. A imunoterapia adjuvante (pembrolizumabe, atezolizumabe) também é considerada, especialmente para pacientes com PD-L1 positivo.
● Tratamento Paliativo: O status do PD-L1 é crucial para guiar a escolha entre monoterapia com imunoterapia ou quimioimunoterapia. Combinações com dupla imunoterapia (nivolumabe + ipilimumabe) são especialmente relevantes para pacientes com PD-L1 baixo.
Novidades em CPNPC (2024-2025): Um Futuro Promissor
O campo do CPNPC está em constante ebulição, com 11 aprovações pelo FDA desde 2024. As novidades se concentram em:
● Novos Alvos e Terapias-Alvo: Novos medicamentos para HER2 (zongertinibe), EGFR éxon 20 (sunvozertinibe), ROS1 (taletrectinibe), e outros.
● Imunoterapia Subcutânea: Formulações mais convenientes para aplicação da imunoterapia.
● Terapia Perioperatória: Refinamento das abordagens combinadas (antes e depois da cirurgia).
● Novos Biomarcadores: Pesquisas para identificar ainda mais marcadores que prevejam a resposta aos tratamentos.
Câncer de Pulmão de Pequenas Células (CPPC): Agressivo, Mas com Novos Aliados
O CPPC, embora menos comum, é um câncer particularmente agressivo. Ele cresce e se espalha muito rapidamente, o que o torna um desafio. No entanto, houve avanços significativos nos últimos anos, especialmente com a integração da imunoterapia.
Características do CPPC:
● Biologia Agressiva: O CPPC tem um perfil molecular mais homogêneo que o CPNPC. Raramente encontramos as "mutações acionáveis" que vemos no CPNPC. Em vez disso, o CPPC é caracterizado por alterações em genes supressores de tumor (como TP53 e RB1) e amplificações de outros genes que promovem o crescimento (como MYC).
● PD-L1: A expressão de PD-L1 no CPPC é geralmente baixa, o que significa que a imunoterapia sozinha não costuma ser tão eficaz, mas em combinação com a quimioterapia, ela se tornou um divisor de águas.
Como Investigamos o CPPC:
A investigação no CPPC é um pouco diferente da do CPNPC:
● Diagnóstico Histopatológico: O diagnóstico é feito pela análise do tecido, confirmando a presença de células pequenas e marcadores neuroendócrinos.
● Sem Busca Rotineira de Mutações Acionáveis: Não costumamos procurar por EGFR, ALK, etc., pois são muito raros no CPPC.
● Exames de Imagem para Estadiamento: São cruciais para definir se a doença é "limitada" ou "extensa":
● TC de Tórax, Abdome e Pelve: Para avaliar o tumor primário, linfonodos e metástases.
● PET-CT: Altamente recomendado para todos os pacientes, detecta lesões metabolicamente ativas e ajuda a diferenciar entre doença limitada e extensa.
● RM de Crânio: Obrigatória para todos os pacientes, mesmo sem sintomas, devido à altíssima incidência de metástases cerebrais no CPPC (até 50% dos pacientes ao longo da doença).
Critérios de Estadiamento VALCSG: No CPPC, usamos um sistema mais simplificado:
● Doença Limitada (DL): O tumor está confinado a um hemitórax, podendo ser incluído em um único campo de radioterapia. Corresponde a cerca de 30% dos casos.
● Doença Extensa (DE): Qualquer doença que ultrapasse os limites da DL, incluindo metástases à distância ou linfonodos no lado oposto do pulmão. A maioria dos pacientes (70%) é diagnosticada com DE.
Estratégias de Tratamento para CPPC:
1. Cirurgia e Radioterapia:
● Cirurgia: Tem um papel muito limitado, restrito a pacientes com doença em estágios muito iniciais (T1-T2 N0 M0), e sempre seguida por quimioterapia e radioterapia.
● Radioterapia (RT): É um pilar fundamental do tratamento:
● Radioterapia Torácica: Essencial para a doença limitada (DL-CPPC), administrada junto com a quimioterapia para aumentar as chances de cura. Para a doença extensa (DE-CPPC), pode ser considerada para consolidar a resposta após a quimioterapia.
● Radioterapia Profilática Craniana (RPC): É uma estratégia fundamental! Como o CPPC tem uma alta chance de se espalhar para o cérebro, a RPC é administrada para prevenir o surgimento de metástases cerebrais, mesmo que a RM não mostre nada. É recomendada para pacientes com boa resposta ao tratamento inicial e bom estado geral.
2. Tratamento para Doença Limitada (DL-CPPC):
O tratamento padrão é a quimiorradioterapia concomitante (quimioterapia e radioterapia ao mesmo tempo), com o objetivo de cura.
● Quimioterapia: Geralmente, etoposídeo e uma platina (cisplatina ou carboplatina).
● Radioterapia Torácica: Administrada desde o primeiro ou segundo ciclo da quimioterapia.
● Terapia de Consolidação com Durvalumabe: Para pacientes com DL-CPPC que não progrediram após a quimiorradioterapia, a imunoterapia com durvalumabe (inibidor de PD-L1) por até 24 meses é um novo padrão de tratamento. O estudo ADRIATIC demonstrou um ganho estatístico e clinicamente significativo na sobrevida global.
● Radioterapia Profilática Craniana (RPC): Recomendada após o tratamento para pacientes com boa resposta, para prevenir metástases cerebrais.
3. Tratamento para Doença Extensa (DE-CPPC):
O tratamento padrão é a quimioimunoterapia sistêmica em primeira linha, com o objetivo de controlar a doença e prolongar a vida.
● Primeira Linha (Quimioimunoterapia): A combinação de quimioterapia (etoposídeo + platina) com imunoterapia (atezolizumabe ou durvalumabe) é o padrão atual. Estudos como o IMpower133 (com atezolizumabe) e o CASPIAN (com durvalumabe) mostraram melhora significativa na sobrevida global.
● Radioterapia Profilática Craniana (RPC): Também é considerada para pacientes com boa resposta à quimioterapia sistêmica.
Linhas Subsequentes de Tratamento (Recidiva ou Progressão):Se o CPPC recidivar ou progredir, o tratamento é desafiador. A escolha depende de quanto tempo o paciente ficou sem tratamento (intervalo livre de tratamento – TLFI):
● Recidiva Sensível (TLFI ≥ 6 meses): Podemos considerar a reexposição a um regime baseado em platina.
● Recidiva Resistente (TLFI < 6 meses): As opções são mais limitadas, mas novos medicamentos estão surgindo:
● Tarlatamabe: Um novo anticorpo biespecífico (anti-DLL3 e anti-CD3) que demonstrou eficácia superior em estudos de fase II e III, representando um avanço para o CPPC refratário.
● Lurbinectedina: Demonstrou atividade em pacientes que progrediram, especialmente com TLFI ≥ 6 meses.
● Topotecano e Irinotecano: São quimioterapias tradicionais ainda utilizadas.
Ensaios Clínicos: São sempre encorajados para pacientes com CPPC recidivado, pois trazem acesso a terapias inovadoras.
Novidades em CPPC (2024-2025): Uma Nova Esperança
O cenário do CPPC, historicamente mais limitado, está mudando rapidamente:
● Imunoterapia em Combinação: A quimioimunoterapia com atezolizumabe ou durvalumabe é agora o padrão de primeira linha.
● Lurbinectedina: Uma opção aprovada para pacientes que progrediram à primeira linha.
● Conjugados Anticorpo-Droga (ADCs): O Tarlatamabe (Imdelltra™), um anticorpo biespecífico, foi recentemente aprovado e representa um grande avanço para o CPPC refratário.
● Biomarcadores Emergentes: A pesquisa continua para encontrar marcadores que nos ajudem a personalizar ainda mais o tratamento.
Conclusão Final: O Futuro do Tratamento do Câncer de Pulmão
O tratamento do câncer de pulmão, seja CPNPC ou CPPC, está em uma era de transformação acelerada. A palavra-chave é personalização. Graças a uma compreensão cada vez mais profunda da biologia molecular e imunológica de cada tumor, somos capazes de oferecer estratégias mais eficazes e com menos efeitos colaterais.
No CPNPC, a medicina de precisão floresce com as terapias-alvo e a imunoterapia, que se consolidaram em todas as fases da doença – antes da cirurgia, depois da cirurgia e na doença metastática. Novos medicamentos e abordagens estão surgindo constantemente.
Para o CPPC, que sempre foi mais desafiador, a integração da quimioimunoterapia e o surgimento de novas classes de agentes como o tarlatamabe, trazem uma esperança renovada e resultados antes inimagináveis.
Em ambos os casos, a abordagem multidisciplinar – ou seja, uma equipe de diversos especialistas trabalhando em conjunto –, um estadiamento preciso com exames de imagem avançados, uma investigação molecular abrangente e a atualização contínua sobre os avanços científicos são indispensáveis.
Nosso compromisso na Neoaccess, e meu como Dr. Rafael Amaral de Castro, é traduzir essas descobertas científicas em benefícios reais para você, nosso paciente, com o objetivo primordial de melhorar sua sobrevida e sua qualidade de vida.
Seja um agente ativo em seu tratamento. Busque informações, faça perguntas e conte com sua equipe médica. Estamos aqui para lutar ao seu lado.
Quer saber mais e continuar essa conversa?
Visite nosso site e siga-nos nas redes sociais para ter acesso a mais informações, dicas e conteúdos exclusivos sobre o combate ao câncer. Juntos, somos mais fortes!
● Instagram Neoaccess: @neoaccess.med
● Facebook Rafael Castro Oncologista: fb.me/rafaelcastroonco
● WhatsApp Business: 61 98197-9192
● YouTube Neoaccess: youtube.com/c/neoaccess
● Instagram Dr. Rafael Castro: @rafaelcastroonco
● Website: www.neoaccess.med.br
Veja e conheça também os vídeos sobre conceitos básicos em oncologia na Aba tratamentos:
saiba mais sob quimioterapia aqui
saiba mais sob imunoterapia aqui
saiba mais em inibidores de EGFR aqui
Oncologia
Apoio e informações sobre tratamentos oncológicos.
Contato
Consultas
onconeoaccess@gmail.com
racaralpes@hotmail.com
+55 61 981979192
61 993439998
61 34489255
© 2025. All rights reserved.